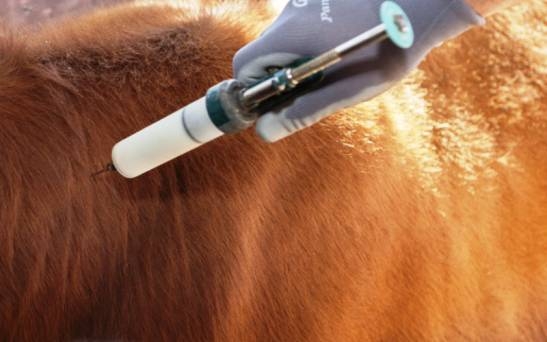
Con esa rara costumbre que tienen los funcionarios de usar el doble apellido cuando firman cosas importantes, la nueva presidenta del Senasa, María Beatriz Giraudo Gaviglio, alias Pilu, refrendó una resolución que flexibiliza todavía más las condiciones para poder importar vacunas contra la fiebre aftosa desde países considerados equivalentes en materia sanitaria.
El Senasa, a instancias del ministro de Desregulación,. Federico Sturzenegger, quien sostiene una guerra abierta contra los laboratorios que proveen esa vacuna a los ganaderos desde hace más de dos décadas, ya había modificado la composición de ese insumo veterinario para facilitar su ingreso desde Brasil, bajando su composición de tetravalente (es decir resistente a cuatro cepas) a bivalente (solo a dos variantes del virus). Se consideraba en el gobierno que ese era un escollo justamente destinado a crear un mercado cautivo para Biogénesis Bagó y CDV, los únicos fabricantes locales.
A pesar de ese cambio, la importación de vacunas desde Brasil que habían anunciado el laboratorio rival de aquellos, Tecnovax, se complicó por otros requisitos que puso el Senasa para el ingreso de vacunas de terceros países, como la prueba de potencia y la habilitación de los laboratorios productores en terceros países. Esto, al menos, es lo que viene denunciando la firma que quiere importar las vacunas desde Brasil.
Adicionalmente un problema no menor es que el laboratorio paulitas Ourofino, de donde procederían las vacunas importadas a menor precio que las locales, no está funcionando actualmente, debido a que Brasil ha decidido dejar de vacunar contra la enfermedad.
De todos modos, con ansias de romper un supuesto monopolio que encarece notablemente el costo de la vacuna para los ganaderos argentinos respecto de los países vecinos, Sturzenegger propicia nuevos cambios para que la importación pueda concretarse sin mayores dificultades, convencido de que esto traerá una mayor competencia en el mercado local.
Sin el escollo ya del ex presidente de Senasa, Pablo Cortese, quien a pesar de flexibilizar los trámites para registrar un producto veterinario importado había puesto ciertas condiciones técnicas, Pilu Giraudo parece haber cumplido las órdenes de Sturzenegger y emitió una nueva resolución este martes en el Boletín Oficial.
En medio de la guerra por la vacuna anti aftosa, renunció Pablo Cortese a la presidencia del Senasa
En concreto, sin rodeos, la nueva Resolución 749/2025 define una “excepción” a las reglas para la importación de vacunas contra la fiebre aftosa, añadiendo un artículo a una resolución de 2017, la 609, para dejar sin efecto algunos requisitos que había impuesto el propio Senasa.
Decía aquella resolución de 2017 que “la importación de antígenos o vacunas solo se autoriza si se cumple con las resoluciones vigentes de este Servicio Nacional respecto al uso de ingredientes de origen bovino y con las que establece la evaluación de la situación de riesgo de Encefalopatía Espongiforme Bovina (EEB) para cada país exportador”.
Además establecía que “las firmas importadoras de vacunas antiaftosa o antígenos inactivados deben estar habilitadas por el Senasa y cumplir con las exigencias y condiciones que se establecen en la presente resolución y las de su país de origen. Además, deben poseer locales e instalaciones en el Territorio Nacional, habilitadas para la conservación y distribución de productos biológicos”.
“La aprobación correspondiente de las instalaciones del elaborador se debe gestionar ante el Senasa, que concederá, previa inspección, la habilitación del establecimiento”, añadía la vieja norma, y agregaba como condición que “previo al inicio de los trámites de habilitación y registro, los interesados deben presentar la habilitación del organismo sanitario oficial del país de origen para la elaboración de vacuna antiaftosa, el registro de la vacuna antiaftosa y la autorización para que el laboratorio elaborador pueda trabajar con las cepas del virus de la Fiebre Aftosa establecidas por el Senasa”.
Quizás el requisito más importante -contra los que también se quejó Tecnovax, al considerarlos demasiado exigentes-, era que “las vacunas o antígenos inactivados importados son sometidos a la totalidad de los controles establecidos en la presente reglamentación, al igual que los aplicados a los antígenos y vacunas elaboradas en el país. Las vacunas deben ser rotuladas en español y en el laboratorio elaborador”.

Todas aquellas requisitorias para habilitar la vacunación con un antígeno importado ahora han quedado en desuso: De hecho, la resolución firmada por Pilu Giraudo establece que “se incorpora como Artículo 57 bis a la Resolución 609/2017 del 9 de septiembre de 2017 el siguiente texto: ARTÍCULO 57 bis. Autorización por equivalencia. Excepciones. Quedan exceptuados de los requisitos establecidos en el artículo precedente los antígenos y las vacunas contra Fiebre Aftosa que estén encuadrados en el proceso de autorización por equivalencia establecido mediante las Resoluciones” previas del Senasa.
Por Resolución 333/2025, del 15 de mayo de pasado, el Senasa implementó una generosa flexibilización a la importación de insumos veterinarios, incluyendo vacunas, desde países considerados “equivalentes”. Ese listado estaba compuesto por países desarrollados y en una primera norma se incluyó solo Uruguay. Pero a los pocos días, el Senasa emitió una corrección incorporando a esa lista a Brasil y Paraguay, los otros dos socios del Mercosur.
Giraudo Gaviglio no justifica demasiado su decisión de mayor flexibilidad para la posible importación de la vacuna antiaftosa desde Brasil, que la firma Tecnovax había anunciado se iba a concretar en octubre próximo, para la segunda campaña de vacunación de este año. Pero quedó claro que a diferencia de Cortese, que provenía de la línea del propio Senasa, hizo caso omiso a las objeciones que habían surgido de la industria veterinaria local.
“Siguiendo los lineamientos dispuestos por el Estado Nacional, a fin de promover el desarrollo de las cadenas productivas y el fomento del libre comercio, y asegurar la libre competencia, deviene necesario modificar la citada Resolución 609/17 a los efectos de armonizar los procedimientos de autorización por equivalencia siempre que no afecten el estatus sanitario de la República Argentina”, ha sido la única explicación.
Todo esto sucede después de que la justicia federal desestimó un recurso de amparo presentado por Biogénesis Bagó contra las normativas de países equivalentes redactadas por el Senasa para favorecer el registro e importación de productos desarrollados en laboratorios extranjeros.
En una segunda resolución publicada en el Boletín Oficial, la número 750/2025, la productora que ha ascendido a presidenta del Senasa determinó mayores facilidades para la posible importación.
Invocando de nuevo que se debe “promover el desarrollo de las cadenas productivas, el fomento al libre comercio y asegurar la libre competencia”, en esta segunda normativa el Senasa decidió “armonizar el procedimiento de control de las series comerciales de aquellos productos autorizados por el procedimiento de equivalencia”.
En este caso se incorpora un artículo nuevo a la reglamentación de enero pasado que habilitó el ingreso de medicamentes veterinarios desde aquellos países. Se refiere al control que el organismo debe realizar sobre las series de vacunas. Y dice: “Los productos veterinarios que hayan sido autorizados mediante el procedimiento de autorización por equivalencia y obtengan el Certificado de Uso y Comercialización (CUC), podrán realizar el control oficial de las series comerciales en el país de origen, siempre que se ajusten a estándares reconocidos internacionalmente y que garanticen el estatus sanitario.”.





Un tema que no se habla cuando se encara la vacunación de aftosa es lo que cobran los entes para su aplicación que cuesta tanto como la vacuna un ROBO
Cuanto daño nos hicieron a los productores con el negocio de esta vacuna. Solo querían recaudar, SENASA, asociaciones, vacunadores, nunca les importó realmente la inmunización de los rodeos, solo juntarla en pala.
El plan de aftosa como funciona actualmente es un robo al productor. Todos los que pagamos la vacuna lo sabemos. La vez que un gobierno intenta cambiar algo, este portal pública información sesgada y política. Que pena